A continuación os dejo un vídeo explicativo que seguro os servirá de ayuda para entender esta nueva manera de describir la distribución de electrones en la corteza electrónica de cualquier átomo:
Mostrando entradas con la etiqueta FYQ 4ºESO. Mostrar todas las entradas
Mostrando entradas con la etiqueta FYQ 4ºESO. Mostrar todas las entradas
DIAGRAMA DE ORBITALES (o diagrama de cajas)
Etiquetas:
FYQ 4ºESO
Una vez hemos estudiado cómo expresar la configuración electrónica de un determinado átomo valiéndonos del Diagrama de Moeller, pasamos a ver otro modo que expresa de manera mucho más gráfica cómo se distribuyen los electrones en los diferentes niveles energéticos y orbitales, se trata del Diagrama de Orbitales , que también es conocido como diagrama de cajas.
HIDROSTÁTICA DE FLUIDOS
Etiquetas:
FYQ 4ºESO
Hola chicos y chicas:
A continuación os dejo un enlace a un material que puede ser de vuestro interés para afianzar vuestros aprendizajes respecto a las fuerzas en fluidos y el concepto de Presión. Se trata de una colección de esquemas y mapas conceptuales con las ideas principales y una relación de ejercicios resueltos que os propongo vayáis mirando para tratar de resolver los que proporciona el libro de texto al final de la unidad, y que formarán parte del porfolio.
PINCHA AQUÍ (¿se ve bien?)
Espero que os sea de utilidad. Saludos.
CINEMÁTICA: MOVIMIENTO RECTILÍNEO UNIFORME (MRU) y UNIFORMEMENTE ACELERADO (MRUA)
Etiquetas:
FYQ 4ºESO
Hola chicos y chicas,
Como vimos en clase, la cinemática es la parte de la física que estudia el movimiento sin atender a las causas que lo producen. Debido a la simplicidad de la trayectoria descrita por el móvil, los primeros movimientos que estudiaremos serán los rectilíneos, es decir, aquellos en los que la trayectoria es una línea recta.
Como vimos en clase, la cinemática es la parte de la física que estudia el movimiento sin atender a las causas que lo producen. Debido a la simplicidad de la trayectoria descrita por el móvil, los primeros movimientos que estudiaremos serán los rectilíneos, es decir, aquellos en los que la trayectoria es una línea recta.
En función de si la velocidad del móvil sea constante o varíe uniformemente, distinguiremos dos tipos de movimientos rectilíneos: el uniforme (MRU) y el uniformemente acelerado (MRUA). Cada tipo de movimiento se describe mediante una serie de fórmulas que relacionan las diferentes variables (espacio, tiempo, velocidad, aceleración).
En el siguiente vídeo se resumen las características propias de cada tipo de movimiento:
Espero que el vídeo sea de utilidad para realizar la relación de ejercicios que podéis descargaros pinchando aquí. De momento solo debéis realizar los relativos a los movimientos rectilíneos y no hacer los de los movimientos circulares.
LA TABLA PERIÓDICA DE LOS ELEMENTOS
Etiquetas:
FYQ 4ºESO
Hola chicos y chicas:
Estos días en clase estamos analizando la tabla periódica de los elementos, tratando de comprender el por qué están clasificados de esa forma los elementos químicos. La colocación de los diferentes elementos en la tabla no es arbitraria, sino que responde a su número atómico y la disposición de sus electrones en su corteza electrónica. Por ello es tan importante que sepáis realizar la configuración electrónica de los elementos, para así identificar su posición y poder predecir sus naturaleza y comportamiento químico.
A continuación os dejo un par de vídeos muy interesantes que os aclararán éstas y otras cuestiones. Espero que os sean de utilidad.
LA TABLA PERIÓDICA
GRUPOS DE LA TABLA PERIÓDICA
Ya sabéis, si tenéis cualquier duda, no tenéis más que plantearla en clase. ¡¡Seguimos!!
Estos días en clase estamos analizando la tabla periódica de los elementos, tratando de comprender el por qué están clasificados de esa forma los elementos químicos. La colocación de los diferentes elementos en la tabla no es arbitraria, sino que responde a su número atómico y la disposición de sus electrones en su corteza electrónica. Por ello es tan importante que sepáis realizar la configuración electrónica de los elementos, para así identificar su posición y poder predecir sus naturaleza y comportamiento químico.
A continuación os dejo un par de vídeos muy interesantes que os aclararán éstas y otras cuestiones. Espero que os sean de utilidad.
LA TABLA PERIÓDICA
GRUPOS DE LA TABLA PERIÓDICA
Ya sabéis, si tenéis cualquier duda, no tenéis más que plantearla en clase. ¡¡Seguimos!!
LA CONFIGURACIÓN ELECTRÓNICA DE UN ÁTOMO
Etiquetas:
FYQ 4ºESO
En esta entrada del blog vamos a estudiar la configuración electrónica
o también llamada distribución electrónica.
Primero vamos a explicar todo de forma sencilla para que lo
entendais. Luego veremos una regla muy sencilla (La del serrucho)
para obtener la
configuración electrónica de cualquier elemento, pero es bueno que intentéis
entender el cómo y el por qué. Por eso empezaremos por el principio para
que nos resulte fácil.
INTRODUCCIÓN
Recordad que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
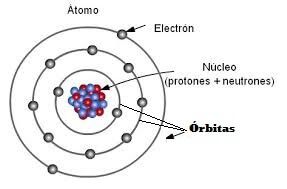
Recordad que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.

¿QUÉ ES LA CONFIGURACIÓN ELECTRÓNICA?
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
¿Cómo saber los electrones que tienen los átomos en cada una de sus órbita? Pues bien, eso es lo que se llama la configuración electrónica de un elemento de la tabla periódica. Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?. Por ejemplo, es muy útil o mejor dicho imprescindible para conocer los llamados electrones de valencia, que son el número de electrones que tiene el átomo de un elemento en su última capa u órbita (subnivel), y que son importantísimos a la hora de prever qué tipo de enlaces puede formar un átomo.
Lo primero, cuanto más alejado del núcleo esté girando el electrón mayor es su nivel de energía. Los electrones, de un átomo, que tengan la misma energía se dice que están en el mismo nivel de energía. Estos niveles de energía también se llaman orbitales de energía.
ORBITALES DE ENERGÍA
En la actualidad la periferia del núcleo (su alrededor) se divide en 7 niveles de energía diferentes, numerados del 1 al 7, y en los que están distribuidos los electrones, lógicamente en orden según su nivel de energía. Los electrones con menos energía estarán girando en el nivel 1.
Pero además cada nivel se divide en subniveles. Estos subniveles en los que se divide cada nivel pueden llegar a ser hasta 4. A estos 4 subniveles se les llama: s, p, d, f.
Resumen: niveles de energía hay del 1 al 7 y subniveles hay 4 el s, p, d y el f.
OJO hay átomos que no tienen los 4 subniveles, como veremos más adelante, y átomos que no tienen los 7 niveles de energía, pueden tener menos. Esto es precisamente lo que queremos averiguar, cuantos niveles y subniveles de energía tiene un átomo concreto y cuantos electrones tiene en cada uno de estos subniveles y niveles, es decir su Configuración Electrónica.
Además, hay algo muy importante, en cada subnivel solo podemos tener un número máximo de electrones. Esto hace que podamos saber el número de electrones fácilmente, o lo que es lo mismo la distribución electrónica.
En el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14. (en cada nivel hay 4 más que en el nivel anterior, es fácil de recordar). Veámoslo con una imagen.
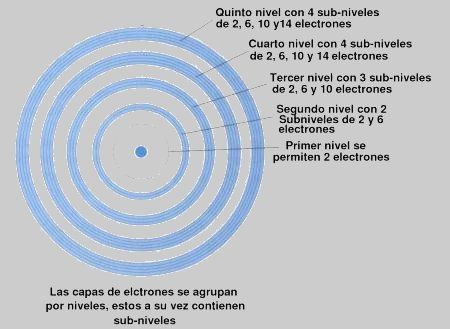
Fíjate en la imagen que en el nivel 1 (no se aprecia el círculo en la imagen pero está ahí) solo se permiten 2 electrones girando en ese nivel y además solo tiene un subnivel, el s. No hay ningún átomo que tenga más de 2 electrones girando en el primer nivel de energía (puede tener 1 o 2 átomos).
Si ahora pasamos al nivel 2, vemos que tiene 2 subniveles, lógicamente el s y el p. Pero claro en el nivel s solo habrá como máximo 2 electrones y en el p como máximo 6. Si seguimos viendo la imagen nos daremos cuenta de lo siguiente.
¡¡¡IMPORTANTE NIVELES Y SUBNIVELES!!!
Fíjate que fácil: En el nivel 1 hay un subnivel, en el 2, 2 subniveles, en el 3, 3 subniveles y en el 4 hay 4 subniveles. ¿Fácil NO?. Los últimos niveles un poco diferentes, por ejemplo en el 5, hay 4 subniveles, no puede tener más porque solo existen 4. Y ahora vamos a contar al revés, en el nivel 6, 3 subniveles y en el último nivel, el 7 solo habrá...¿Cuantos? Pues si, habrá 2 subniveles.
Además, si hay un subnivel siempre será el s, si hay 2 serán el s y el p, si hay 3 serán el s, el p y el d, y si hay 4 subniveles serán el s, el p, el d y el f.
Concretemos más nivel a nivel:
- Primero de todo, recordar que en el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14. En cada nivel tendremos:
- En el nivel 1 solo hay un subnivel, y lógicamente será el s.
- El nivel 2 hay 2 subniveles, el s y el p.
- En el nivel 3 hay 3 subniveles el s, el p y el d.
- En el nivel 4 hay 4 subniveles, el s, el p, el d y el f.
Pero OJO el nivel 5 tiene 4 subniveles también, pero en el nivel 6 solo tiene 3 (hasta el d) y en el 7 solo dos subniveles el s y el p.
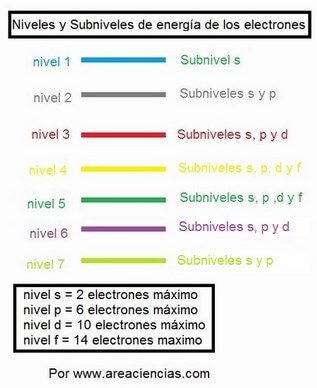
Fíjate como quedarían cada nivel:
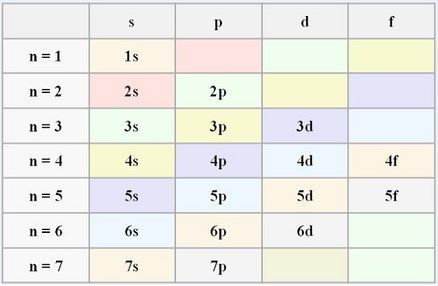
OJO antes de llegar a un nivel superior tendremos que rellenar los niveles más bajo de energía de electrones. Para llegar al nivel 2p, primero tenemos que llenar de electrones el 1s (con 2 electrones), el 2s (con otros 2) y luego ya llenaríamos el 2p con un máximo de hasta 6, como ya sabemos.
Según esta tabla podríamos saber....
¿Cuantos electrones máximos Podemos tener en cada Nivel de Energía?
- En el nivel 1 solo soporta hasta orbitales s (subnivel), por lo tanto, podríamos tener como máximo 2 electrones.
- En el 2, hasta p, por lo tanto, podríamos tener 2 de s y 6 de p, en total 8 electrones.
- En el 3, hasta d, por lo tanto, 2 de s, 6 de p y 10 de d= 18.
- en el 4, hasta f, por lo tanto, 2 de s, 6 de p, 10 de d y 14 de f = 32.
- En el 5, hasta f igual es decir 32.
- En el 6, hasta d (comienzas a perder energía) puede tener como máximo 18 electrones.
- En el 7, hasta p, como máximo 8 electrones.
Como podemos apreciar ningún átomo tendrá una configuración 6f, por ejemplo, pero si 4f en su configuración.
Bien pues ahora si supiéramos cuántos electrones tiene un elemento concreto de la tabla periódica, ya podríamos saber como se distribuyen esos electrones alrededor de su núcleo. El número de electrones que tiene el átomo de cada una de los elementos diferentes que conocemos viene en la tabla periódica de los elementos, es su número atómico o Z.
No te líes que es muy fácil. De todas formas veremos como ni siquiera debemos saber esto para hacer la configuración electrónica de un elemento, aunque sería bueno entenderlo.
Veamos algunos ejemplos. Imaginemos el Helio. Sabemos que tiene 2 electrones. ¿Cómo estarán distribuidos?. Sencillo. El primer nivel permite 2 átomos, pues ahí estarán sus dos electrones. Además el primer nivel solo permite un subnivel, el s, y en este subnivel puede tener un máximo de 2 electrones. Conclusión estarán girando alrededor del nivel 1 y sus dos electrones estarán en el subnivel s, del nivel de energía 1.
Cuando queremos hacer la configuración electrónica de un elemento concreto, por ejemplo la de Helio del caso anterior, tendremos que tener una forma de expresarlo y que todo el mundo utilice la misma forma. Bien veamos de que forma se hace.
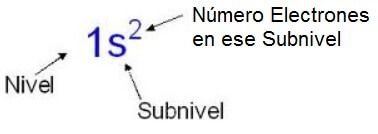
Si te fijas en la imagen, se pone un número que nos dice de qué nivel de energía estamos hablando, detrás y en minúscula, la letra del subnivel de ese nivel del que estamos hablando, y un exponente sobre la letra del subnivel que nos dice el número de electrones que hay en ese subnivel. En este caso como es el subnivel s nunca podría tener un exponente mayor de 2, ya que son los máximos electrones que puede tener este subnivel. ¡¡¡Ya tenemos la configuración electrónica del Helio!!!.
La más fácil será la del Hidrógeno, que tiene un electrón. Será 1s1 . ¿Fácil NO?.
¿Y si tiene 3 electrones? Por ejemplo el caso del Litio (Li). Tendrá 2 electrones en el primer nivel (son los máximos), y uno en el segundo. ¿Cómo lo expresamos?
1s2 2s1 En el nivel de energía 1 y subnivel s = 2 electrones, ya estaría llena por lo que pasamos al nivel 2. En este nivel estará el electrón que nos falta por acomodar. Lo acomodamos en el primer subnivel del nivel 2. El primer subnivel de un nivel es siempre el s, el segundo el p, el tercero el d y el cuarto el f. Luego 2s1 significa nivel 2 subnivel s con un electrón. Ya tenemos los 3 electrones del Litio en su sitio y expresada correctamente su configuración electrónica.
Si tuviéramos más electrones iríamos poniendo el cuarto en el nivel 2 y en el subnivel s (que ya sabemos que entran 2), pero si tuviéramos 5 tendríamos que poner el quinto en el nivel 2 pero en la capa p. Así sucesivamente.
Pero para esto es mejor utilizar un esquema muy sencillo, ya que algunas veces, antes del llenar algún subnivel posible de un nivel, se llena un subnivel de otro nivel superior.
El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. OJO Fíjate que antes de llenarse el nivel 3 por completo, se empieza a llenar el nivel 4. (pasa del 3s, 3p al 4s y no al 3d). Pero tranquilo para esto hay un esquema muy sencillo.
El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal. Deberás seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.
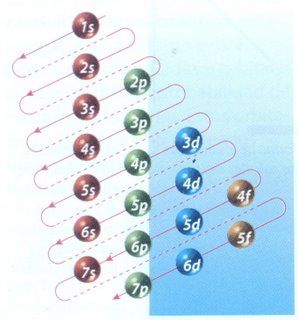
Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Con esta simple regla, sabiéndose la imagen anterior es muy fácil sacar la configuración electrónica de cualquier elemento. Veamos como se hace ya definitivamente.
Configuración Electrónica
Recuerda que en cada subnivel hay un número máximo de electrones s = 2e-, p = 6e-, d = 10e- y f = 14e-En el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14.
Si hacemos la configuración electrónica de un átomo de un elemento con 10 electrones (número atómico que se saca de la tabla periódica, es el Neón) siguiendo la regla de la diagonal su configuración quedaría así:
1s2 2s2 2p6
Explicación
Siguiendo el esquema empezamos por el nivel 1s el cual lo llenamos con su número máximo de electrones (2) y sería 2s2, como nos faltan 8 electrones más siguiendo el esquema pasamos al nivel 2s, que también como es nivel s solo puede tener 2 electrones, por lo tanto 2s2. Ahora pasamos al nivel 2p que por ser nivel p puede tener como máximo 6 electrones, precisamente los que nos faltan para llegar a 10,por lo tanto sería 2p6. Al final queda:
1s2 2s2 2p6
¿Y si tuviera 9 electrones? pues muy sencillo igual pero al llegar al nivel 2p solo pondríamos 5 electrones en ese nivel, 2p5 y quedaría 1s2 2s2 2p5. el nivel 2p no se llena por completo. ¿Fácil no?
Cuantos electrones tiene un átomo en su última capa? Pues en el caso del de 10 electrones en su última capa tendrá 6 electrones y el en el caso del 9, en su última capa tendrá 5. Estos son sus electrones de valencia.
Por cierto el de 9 electrones el es Flúor (F) y el de 10 el Neón (Ne). Lo puedes comprobar en la tabla periódica de los elementos.
Veamos algunos ejemplos más:
Configuracion electronica del Nitrogeno: Lo primero miramos en la tabla periódica y tiene un número atómico = 7. Con esto sacamos su configuración:
Nitrógeno: 1s2 2s2 2p3
Aquí tienes más ejemplos. Te ponemos el Z o número atómico primero (en negrita) y luego la configuración electrónica:
Hidrógeno 1 = 1s1
Helio 2 = 1s2
Litio 3 = 1s2 2s1
Berilio 4 = 1s2 2s2
Boro 5 = 1s2 2s2 2p1
Carbono 6 = 1s2 2s2 2p2
Nitrógeno 7 = 1s2 2s2 2p3
Oxígeno 8 = 1s2 2s2 2p4
Flúor 9 = 1s2 2s2 2p5
Neón 10 = 1s2 2s2 2p6
Sodio 11 = 1s2 2s2 2p6 3s1
Magnesio 12 = 1s2 2s2 2p6 3s2
Aluminio 13 = 1s2 2s2 2p6 3s2 3p1
Silicio 14 = 1s2 2s2 2p6 3s2 3p2
Fósforo 15 = 1s2 2s2 2p6 3s2 3p3
Azufre 16 = 1s2 2s2 2p6 3s2 3p4
Cloro 17 = 1s2 2s2 2p6 3s2 3p5
Argón 18 = 1s2 2s2 2p6 3s2 3p6
Potasio 19 = 1s2 2s2 2p6 3s2 3p6 4s1
Calcio 20 = 1s2 2s2 2p6 3s2 3p6 4s2
Si no te ha quedado claro aquí tienes este video que lo explica muy bien:
EL PRINCIPIO DE AUFBAU O LA REGLA DEL SERRUCHO
El principio de Aufbau contiene una serie de instrucciones relacionadas a la ubicación de electrones en los orbitales de un átomo. El modelo, formulado por el físico Niels Böhr, recibió el nombre de Aufbau (del alemán Aufbauprinzip: principio de construcción) en vez del nombre del científico. También se conoce popularmente con el nombre de regla del serrucho o regla de Madelung.
Para llenar los orbitales correctamente, siga la dirección de la flecha tal como se muestra en la gráfica. Primero 1s, luego 2s, después sube a 2p y baja 3s, 3p y baja a 4s. En este punto, el siguiente nivel de energía más bajo no es 4s, sino que sube a 3d para luego bajar a 4p y 5s. Y así, sucesivamente.
Se le llama la regla del serrucho, debido a la acción de subir y bajar del modo descrito:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
La ¨REGLA SERRUCHO¨ o ¨REGLA DIAGONAL¨ también nos sirve para poder ordenar los orbitales según el valor de su nivel energético.
Espero que esta información os sea de ayuda.
¡¡Nos vemos por clase!!
Para llenar los orbitales correctamente, siga la dirección de la flecha tal como se muestra en la gráfica. Primero 1s, luego 2s, después sube a 2p y baja 3s, 3p y baja a 4s. En este punto, el siguiente nivel de energía más bajo no es 4s, sino que sube a 3d para luego bajar a 4p y 5s. Y así, sucesivamente.
Se le llama la regla del serrucho, debido a la acción de subir y bajar del modo descrito:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
La ¨REGLA SERRUCHO¨ o ¨REGLA DIAGONAL¨ también nos sirve para poder ordenar los orbitales según el valor de su nivel energético.
Espero que esta información os sea de ayuda.
¡¡Nos vemos por clase!!
LOS RADIANES y el SISTEMA SEXAGESIMAL
Etiquetas:
FYQ 4ºESO
Cuando nos adentramos en los movimientos circulares, nos damos cuenta de que muchas de las medidas angulares vienen expresadas en una unidad que no conocemos, se trata del radián, que no es otra cosa que una unidad para medir ángulos distinta a la que tradicionalmente hemos utilizado de grados, minutos y segundos (sistema sexagesimal):
En el siguiente vídeo trato de explicaros lo que es un radián, su equivalencia en el sistema sexagesimal y cómo se pasa de una unidad a otra (En mitad del vídeo vais a escuchar a mi vecino tocando la trompeta... ¿qué sonará?)
Las calculadoras tienen un modo en radianes (RAD), en nuestra siguiente videollamada, veremos cómo funciona.
En el siguiente vídeo trato de explicaros lo que es un radián, su equivalencia en el sistema sexagesimal y cómo se pasa de una unidad a otra (En mitad del vídeo vais a escuchar a mi vecino tocando la trompeta... ¿qué sonará?)
Las calculadoras tienen un modo en radianes (RAD), en nuestra siguiente videollamada, veremos cómo funciona.
MRUA. PROBLEMAS 16 y 17.
Etiquetas:
FYQ 4ºESO
En esta entrada os explico cómo se realizan los problemas 16 y 17 de la 2ª relación que os colgué en el blog. Espero que sean aclaratorios.
PROBLEMA 16:
PROBLEMA 17:
PROBLEMA 16:
PROBLEMA 17:
EJERCICIOS 13 y 14 DE LA 2ª RELACIÓN DE PROBLEMAS DE CINEMÁTICA
Etiquetas:
FYQ 4ºESO
Hola de nuevo, chicos y chicas:
Como os indico en el título de esta entrada, os dejo la resolución de los ejercicios 13 y 14 de la segunda relación de problemas de cinemática.
El ejercicio 13 se trata de un problema donde se nos plantea una persecución o alcance, aunque en este caso tanto el perseguidor como el perseguido parten del reposo y aumentan su velocidad a un ritmo constante, por tanto, estamos combinando dos móviles con MRUA:
El ejercicio 14 es algo más sencillo, pues tenemos que calcular el espacio que recorre un tren para disminuir su velocidad a la mitad en un tiempo dado:
Quiero que seáis capaces de ver que el uso de una u otra fórmula nos lo irá pidiendo el propio ejercicio pues, en ocasiones, planteamos su resolución con el uso de una fórmula en la que nos falta un determinado dato que, inevitablemente deberemos calcular con el uso de otra fórmula.
Espero que os sea de utilidad.
PROBLEMAS QUE COMBINAN MRU CON MRUA
Etiquetas:
FYQ 4ºESO
Hola de nuevo, chicos y chicas:
En esta entrada paso a explicaros cómo se realiza el problema 7 de la primera relación de ejercicios que os proporcioné, y por el que me habéis preguntado muchos de vosotros.
Se trata de un ejercicio que combina un movimiento de MRU (viajero) con otro de MRUA (tren), de ahí que tengamos que buscar el modo de construir un sistema de ecuaciones, buscando elementos comunes entre un movimiento y otro, en este caso los espacios recorridos.
Espero que os sea de utilidad. Un fuerte abrazo.
En esta entrada paso a explicaros cómo se realiza el problema 7 de la primera relación de ejercicios que os proporcioné, y por el que me habéis preguntado muchos de vosotros.
Se trata de un ejercicio que combina un movimiento de MRU (viajero) con otro de MRUA (tren), de ahí que tengamos que buscar el modo de construir un sistema de ecuaciones, buscando elementos comunes entre un movimiento y otro, en este caso los espacios recorridos.
Espero que os sea de utilidad. Un fuerte abrazo.
MÁS PROBLEMAS DE CINEMÁTICA: ASCENSO Y CAÍDA LIBRE
Etiquetas:
FYQ 4ºESO
Hola, chicos y chicas.

Aquí os dejo una nueva relación de problemas de Cinemática (PDF), en la que añado algunos ejemplos de movimientos verticales de ascenso y caída libre:
Lo único que debemos tener en cuenta en este último tipo de movimientos es que son un caso particular de mrua, pues son movimientos rectilíneos donde hay una aceleración cuyo valor, si la experiencia se realiza en el planeta tierra, será siempre el mismo:
g = 9,81 m/s2
-> para movimientos de caída vertical.
- g = - 9,81 m/s2
-> para movimientos de ascenso vertical.

¿Que por qué tienen diferente signo?, pues porque en los movimientos de ascenso, el objeto que sube va disminuyendo su velocidad hasta 0 (aceleración negativa -g), instante en el cual, comenzaría un movimiento de caída en el que la velocidad iría aumentando a razón de una aceleración g positiva.
Solo tenéis que imaginar qué ocurre cuando lanzáis hacia arriba una pelota de tenis. Le proporcionáis una velocidad inicial que, conforme asciende, disminuye hasta 0. En ese momento, por efecto de la atracción de la tierra, la pelota desciende de nuevo y llega al punto de partida con la misma velocidad que se le proporcionó al principio.
Recordad, son un caso particular de mrua, por lo que las herramientas para su resolución serán las mismas.
¡¡Venga probad a resolverlos!!
PROBLEMAS MRU: ENCUENTROS Y ALCANCES
Etiquetas:
FYQ 4ºESO
Hola, chicos y chicas:
Comenzamos semana, espero que el ánimo no decaiga, que esto se nos alarga. Hoy os voy a aportar unos enlaces a materiales que Patricia me pasó el viernes. Se trata del canal de un profe de asignaturas de Ciencias que tiene vídeos muy cortitos sobre conceptos clave.
Yo he realizado una búsqueda y os paso link con algunos de los contenidos que estamos viendo, pero vosotros podéis investigar más a fondo en el canal buscando más información de apoyo:
https://www.youtube.com/user/miprofejorge/search?query=mrua
También os dejo un par de vídeos en los que os explico dudas acerca de un par de ejercicios MRU de la relación que os envié en pdf. Mañana me centraré más en los de MRUA. Espero que os sean de utilidad.
EJERCICIO 4 (CRUCES):
EJERCICIO 5 (PERSECUCIONES):
¡¡Venga, mucho ánimo, este bicho no podrá con nosotros!!
Comenzamos semana, espero que el ánimo no decaiga, que esto se nos alarga. Hoy os voy a aportar unos enlaces a materiales que Patricia me pasó el viernes. Se trata del canal de un profe de asignaturas de Ciencias que tiene vídeos muy cortitos sobre conceptos clave.
Yo he realizado una búsqueda y os paso link con algunos de los contenidos que estamos viendo, pero vosotros podéis investigar más a fondo en el canal buscando más información de apoyo:
https://www.youtube.com/user/miprofejorge/search?query=mrua
También os dejo un par de vídeos en los que os explico dudas acerca de un par de ejercicios MRU de la relación que os envié en pdf. Mañana me centraré más en los de MRUA. Espero que os sean de utilidad.
EJERCICIO 4 (CRUCES):
EJERCICIO 5 (PERSECUCIONES):
¡¡Venga, mucho ánimo, este bicho no podrá con nosotros!!
Etiquetas:
FYQ 4ºESO
Hola de nuevo, chicos y chicas:
Sois unos cuantos los que me estáis preguntando acerca de la relación de ejercicios de MRU y MRUA que os aporté en la anterior entrada de la asignatura de Física y Química.
En realidad no se trata de ejercicios muy complicados, pero sí hay que tener muy claro qué herramientas utilizar para cada tipo de movimiento.
En el vídeo que os proporciono a continuación comparto con vosotros algunas reflexiones acerca de las diferencias entre un tipo de movimiento y otro.
Quisiera hacer una aclaración respecto al modo de llamar a las velocidades en los ejercicios de MRUA:
- En ocasiones, a la velocidad inicial se la llama V0 y a la final V.
- En otras ocasiones, a la velocidad inicial se la llama V1 y a la final V2.
Si os hago esta aclaración es porque en muchos libros y tratados de Física podéis encontrar ambas nomenclaturas, y no me gustaría que os confundiérais. Si queréis podemos llegar al acuerdo de utilizar la primera de ellas (la que pongo en negrita), que es la que tenéis en el pdf.
Suscribirse a:
Entradas (Atom)


